Соединения меди (Сu) в Мурманске
Ознакомьтесь с перечнем товаров в данной категории. Вся предоставленная в каталоге продукция изготовлена по действующим стандартам качества. У нас вы сможете заказать оптом Соединения меди (Сu)
| Наименование | Цена | Ед. изм. | |
|---|---|---|---|
| Медь (II) Свинец (II) Оксид-Фталат чистый | По запросу | Оставить заявку | |
| Карбонат меди | По запросу | Оставить заявку | |
| Медный купорос | По запросу | Оставить заявку | |
| Медный порошок ПМС-1 | По запросу | Оставить заявку | |
| Оксид меди (II) | По запросу | Оставить заявку | |
| Пудра медная ПМР | По запросу | Оставить заявку | |
| Пудра медная ПМР М100 | По запросу | Оставить заявку | |
| Медный купорос технический марка "А" сорт 1 | По запросу | р | Оставить заявку |
| Гидроксид меди | от 1050 | руб/кг | Оставить заявку |
| Медь (II) оксид (порошок) ЧДА | По запросу | Оставить заявку |
Соединения меди (Cu)
Характеристика элемента
Медь – один известнейших и распространенных химических элементов. По системе Д.И. Менделеева стоит 29-ой по счету. Как известно, номер элемента соответствует общему числу всех электронов ядра атома. Таким образом, у меди 29 электронов, и 4 из них способны вступать в реакции с другими элементами. В исходном состоянии является металлом с типично блестящей поверхностью розоватого оттенка, что является отличительной особенностью меди.

Ввиду строения атомных оболочек медь относят к переходным d-металлам. Для данного типа элементов является характеризующим:
- наличие новой d-орбитали;
- обширный интервал степеней окисления (от -2 до +8);
- низкая электроотрицательность;
- склонность к образованию комплексных ионов.
В частности, интервал степеней окисления для меди – от +1 до +4.
На латинском название звучит как «купрум» и берет свое начало от острова Кипр, где был обнаружен богатый медный рудник. Первые упоминания слова «медь» встречаются в древнерусских рукописях. Такое название не может быть однозначно истолковано, так как этимология не имеет четких оснований, потому что элементарная медь применялась в качестве материала еще в эпоху энеолита – примерно с 4-го тысячелетия до н.э. С греческого «медь» может быть переведено как «рудник».
Медь часто встречается в природе в самородном состоянии, что является достаточно редкой особенностью среди металлов. При этом чистота медного самородка может достигать 98%. Именно поэтому и была открыта на заре зарождения орудий труда. Содержание в земной коре – 0,005 масс. %, в ее нижней части может достигать до 0,01 масс. %, что ставит медь на 23-е место по распространенности.
Наиболее известные минералы меди – это медный колчедан – халькопирит, халькозин, куприт, малахит, борнит. В основном это сульфиды меди разного состава. Например, халькопирит – это двойной медно-железный сульфид.
Получение меди
В России плавить медь стали только к 15-му веку. Известный Пушечный двор в Москве был основан в том же веке. Главная специализация бронзовое литье. Известные архитектурные памятники Царь-пушка и Царь-колокол были отлиты там. Основными сырьевыми источниками с точки зрения промышленного получения меди являются халькопирит, малахит и самородки.
Нередко в медной руде присутствуют такие примеси, как молибден, никель, кобальт, иногда благородные металлы. Так что нередко руду предварительно обогащают. Примерная схема технологического процесса может быть представлена так:
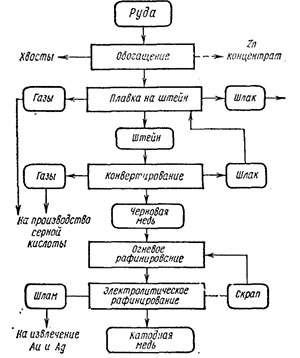
Анод и катод, на котором выделяется медь, в данном случае тоже состоят из меди. Из особенностей можно выделить то, что анод растворяется в ходе процесса, тем самым повышая концентрацию меди.
Основные соединения и применение
Как отмечалось ранее, у меди 4 электрона, которые могут участвовать в реакциях. При этом чаще всего металл окисляется до степени окисления +2, менее характерной является +1. Остальные степени окисления редки и встречаются только в комплексных соединениях. Существуют даже сложные комплексы с медью в степени окисления +5. Наличие такого иона было обнаружено в 90-х годах прошлого века, то есть не так давно.
Медь проявляет слабые восстановительные свойства. Настолько слабые, что она не вытесняет водород из разбавленных кислот. Но растворяется в концентрированных с образованием солей. Например, в серной образует медный купорос или сульфат меди, который характеризуется сине-голубой окраской.
С точки зрения химических свойств медь изучена достаточно хорошо. И при тех или иных условиях она взаимодействует практически со всеми неметаллами. Также как слабый восстановитель способна вытеснять менее активные металлы из их солей. Например, легко вытесняет серебро.
С точки зрения промышленного сектора наиболее интересные соединения меди – это:
- оксиды меди (I и II) – бордовый и черный порошок;
- гидроксид меди – голубой порошок;
- галогениды меди – среди них хлорид и йодид меди;
- соли – карбонат меди, медный купорос.
Главнейшие сферы применения меди и ее соединений – это электротехника и металлургия. Из металла делают провода, силовые кабели, проводники, так как чистая беспримесная медь имеет низкую токопроводимость.
В металлургии из меди изготавливают трубы и делают сплавы на ее основе, которые впоследствии используются для самых разнообразных целей – от добавок в строительные смеси до производства ювелирных изделий. Важнейшие из них – дюралюминий, латунь и бронза, которые могут содержать совершенно разнообразные добавки.
В частности, оксиды меди применимы в синтезе соединений, которые в свою очередь применимы для изготовления материалов, не проводящих электрический ток.
Медный купорос широко используется в строительстве. Им обрабатывают кирпич с целью смочить поры и предотвратить образование наплывов на поверхности. Также может использоваться как источник серы и меди в сельхоз промышленности.
Предлагаем купить соединения меди в нашей компании по привлекательной цене. С полным перечнем продукции можно ознакомиться выше.
Купить соединения меди (сu) в городе Мурманск
Оформите заявку через наш интернет-сайт или свяжитесь с нами по указанному телефонному номеру. Возможна доставка и самовывоз. Предоставляем информацию по телефону +7 (800) 300-60-34. Электронные запросы принимаются на murmansk@poly-chem.ru
*Цена, указанная на сайте, не является публичной офертой, определяемой положениями ч. 2 ст. 437 Гражданского кодекса Российской Федерации. Итоговая стоимость рассчитывается при оформлении заказа.


